发布日期:2025-07-31 浏览量:12873

蓝箭航天空间科技股份有限公司
蓝箭航天于2025年7月25日同中金公司签署辅导协议,正式启动科创板上市进程。
这意味着,蓝箭航天或将成为“科创板商业航天第一股”——值得注意的是,资本市场持续加大对商业航天的政策支持力度。今年6月18日,证监会发布《关于在科创板设置科创成长层增强制度包容性适应性的意见》,以设置科创成长层为抓手,重启未盈利企业适用科创板第五套标准上市并扩大适用范围,支持人工智能、商业航天、低空经济等更多前沿科技领域企业上市。
公开资料显示,蓝箭航天是国内领先的航天运输系统创建及运营企业,成立于2015年,致力于构建以中大型液氧甲烷运载火箭为中心的“研发、制造、试验、发射”全产业链条,打造航天领域的科技综合体,为全球市场提供高性价比、高可靠性的航天运输服务。

蓝箭航天是全国首家取得全部准入资质、唯一基于自研液体发动机实现成功入轨的民营运载火箭企业,并于2018年10月27日完成中国首次民营运载火箭发射。
2023年7月,蓝箭航天完成全球首款液氧甲烷运载火箭朱雀二号遥二成功入轨,标志着中国全面掌握液氧甲烷运载火箭关键技术,朱雀二号成为中国民商航天首款进入量产及商用的液体火箭。
2024年12月,国家制造业转型升级基金对蓝箭航天投资9亿元;今年6月,《2025全球独角兽榜》发布,蓝箭航天以200亿元企业估值位列榜单第418位。
2025年4月15日,蓝箭航天第100台天鹊系列液氧甲烷火箭发动机在浙江湖州动力制造基地正式下线。标志着我国民营商业航天在火箭动力系统领域成功实现了从“单台突破”到“批量制造”的跨越,迈入“三位数时代”,开启规模化应用新阶段。
2025年6月20日,蓝箭航天自主研制的朱雀三号可重复使用运载火箭一级动力系统试车,在东风商业航天创新试验区蓝箭航天液氧甲烷火箭发射2号工位顺利完成。
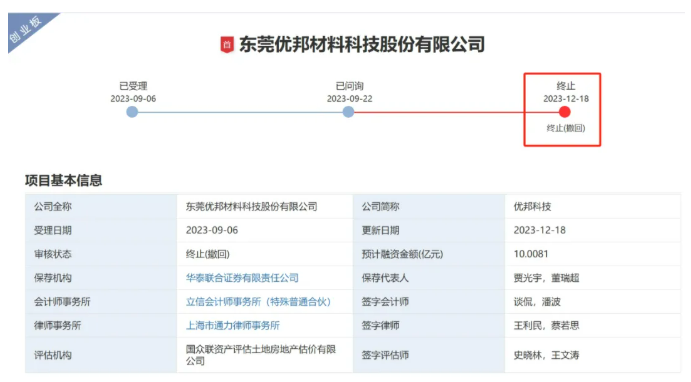
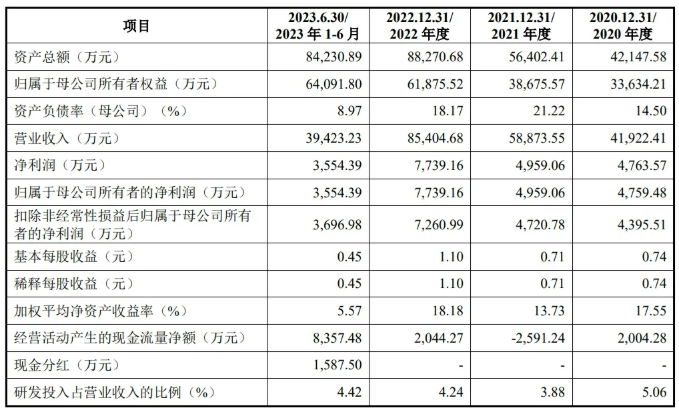
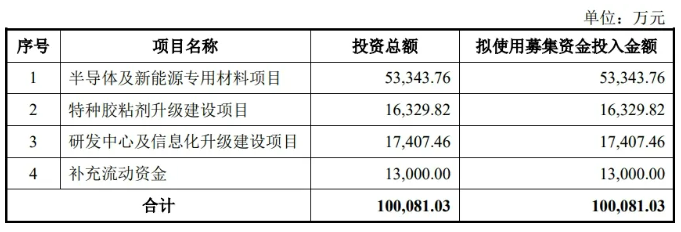
东莞优邦材料科技股份有限公司

北京艺妙神州生物医药股份有限公司
艺妙神州于2025年7月23日同中信证券签署辅导协议,正式启动科创板上市进程。

艺妙神州成立于2015年,是一家专注于以原研基因细胞药物技术应用于重大疾病(癌症、自身免疫性疾病等)治疗的创新药企,拥有一站式自主基因细胞药物研发和产业化平台,已获批7项中国和1项美国CAR-T新药临床试验批准以及北京首张基因细胞药物《药品生产许可证》,研发管线覆盖淋巴瘤、白血病、骨髓瘤等血液肿瘤和肝癌、胃癌、结直肠癌、黑色素瘤等实体肿瘤。
其中,血液肿瘤CAR-T产品IM19针对复发难治弥漫大B细胞淋巴瘤适应症已在中国提交产品上市申请(NDA)并获得受理,实体肿瘤CAR-T产品IM96获得中国NMPA和美国FDA批准的临床试验批件。
具体来讲,IM19采用了创新的CAR分子设计和生产工艺,可提供更为特异性的治疗效果,显著提升r/r DLBCL患者的生存时间和生存质量,为患者带来了治愈的可能性。截至目前,在晚期淋巴瘤适应症领域美国FDA已批准了数款CAR-T细胞治疗产品上市,而我国还未有国产原研的CAR-T细胞治疗药物获准上市。IM19获批上市后,将有效填补国产自主CAR-T细胞药物在淋巴瘤适应症领域的市场空白。
而IM96则是全球唯一一款在中国和美国均获临床试验批准的靶向GUCY2C的CAR-T细胞候选药物。此前,IM96已于2024年10月在中国获批治疗结直肠癌,并成为国内首个针对该适应症的CAR-T细胞候选药物。
【咨询&业务合作:15951890105】